Le ossa costituiscono un tessuto vivente in continuo rinnovamento per tutto il corso della vita; i processi di formazione di nuovo tessuto osseo ad opera degli osteoblasti e processi di riassorbimento ad opera degli osteoclasti che permettono la regolazione della forza delle ossa si alternano costantemente. Nel ciclo di rimodellamento osseo, gli osteoclasti rimuovono il tessuto vecchio e danneggiato e i costituenti immagazzinati, tra cui il calcio, minerale essenziale della matrice ossea, sono rilasciati nel circolo sanguigno. Al tempo stesso gli osteoblasti producono nuovo tessuto, inducendo la produzione di osteocalcina, una proteina che nella sua forma attivata è in grado di legare calcio e incorporarlo a livello delle ossa.
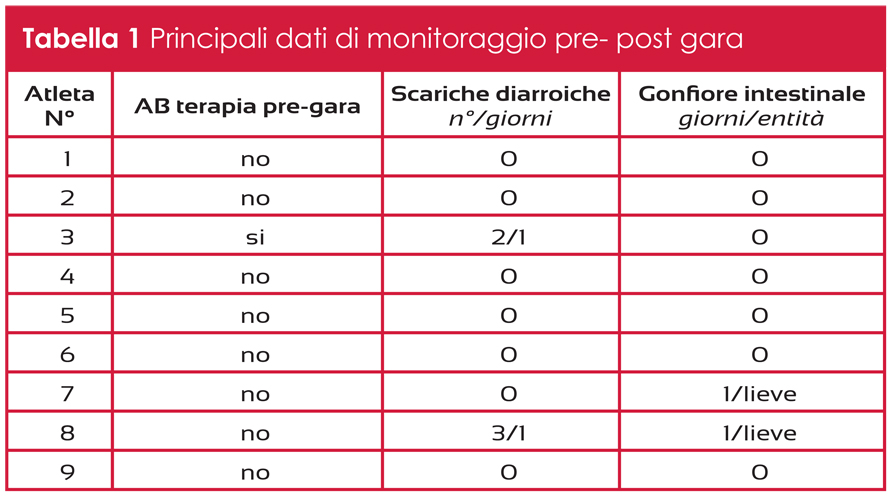
Uno squilibrio tra i due processi a favore dell’attività di riassorbimento degli osteoclasti incrementa la fragilità ossea con conseguente sviluppo di osteoporosi.
Il numero di persone affette da osteopenia ed osteoporosi, stati caratterizzati da bassi livelli di densità minerale ossea, è in costante aumento; si stima che circa 75 milioni di persone tra Europa, USA e Giappone siano affette da osteoporosi e tra queste le donne costituiscono la stragrande maggioranza. Esiste una comprovata correlazione tra osteoporosi e fratture; l’incidenza registrata per donne e uomini è del 30-50% e 15-30% rispettivamente.
Il rischio di fratture da osteoporosi a livello mondiale varia in funzione del paese d’origine e il fatto che l’incidenza continui ad aumentare, nonostante i principali fattori di rischio (dieta, esercizio fisico, intake di calcio e vitamina D3) siano ben conosciuti, suggerisce che questi vengano del tutto trascurati.
Il Giappone è uno dei paesi con la più bassa incidenza di malattie ossee e cardiovascolari; questo è probabilmente riconducibile all’elevato consumo di “natto”, un piatto tipico a base di soia fermentata, contenente elevate quantità di vitamina K2 o mena chinone-7. Numerosi studi sono stati condotti per dimostrare gli effetti benefici della vitamina K2 sulla salute ossea e in uno di questi è stato messo in evidenza come l’assunzione costante di natto sia associata ad un aumento della BMD in corrispondenza del collo femorale.
Menachinone-7 (MK-7) appartiene alla famiglia delle vitamine K, micronutrienti necessari per la sintesi dei fattori di coagulazione e l’attivazione di proteine coinvolte nel processo di costruzione ossea e di inibizione della calcificazione vascolare.
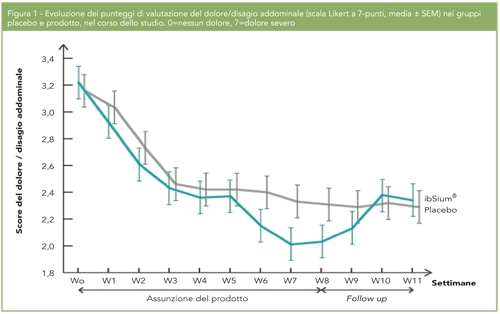
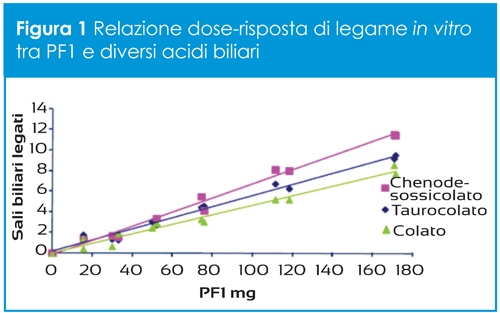
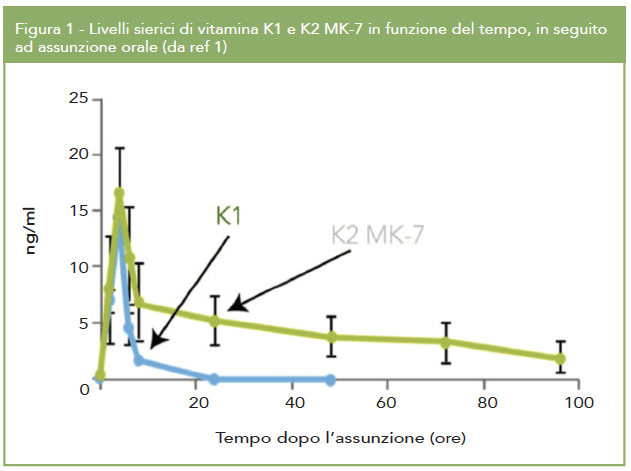
MK-7 è costituito da sette unità isoprenoidi e per questo motivo risulta essere caratterizzato da una maggiore lipofilia rispetto alla vitamina K1 e a MK-4, con conseguente maggiore assorbimento, distribuzione e biodisponibilità. Infatti, mentre queste ultime hanno una emivita ridotta, di circa 1-2 ore, MK-7 ha una emivita decisamente più elevata, di circa 2-3 giorni (Fig.1) (1).
K2 Vital®, sviluppato e brevettato dalla KappaBioscience e distribuito in Italia da Giusto Faravelli SpA, è un prodotto di origine sintetica a base di puro mena chinone-7 trans, che costituisce un valido supporto per le malattie cardiovascolari e per il metabolismo del tessuto osseo, aiutando a prevenire l’osteoporosi.
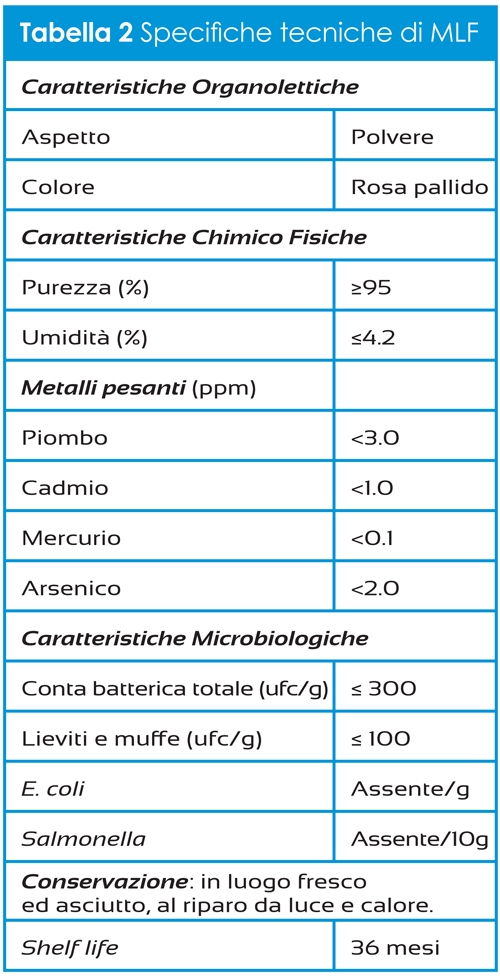
Composizione e specifiche tecniche
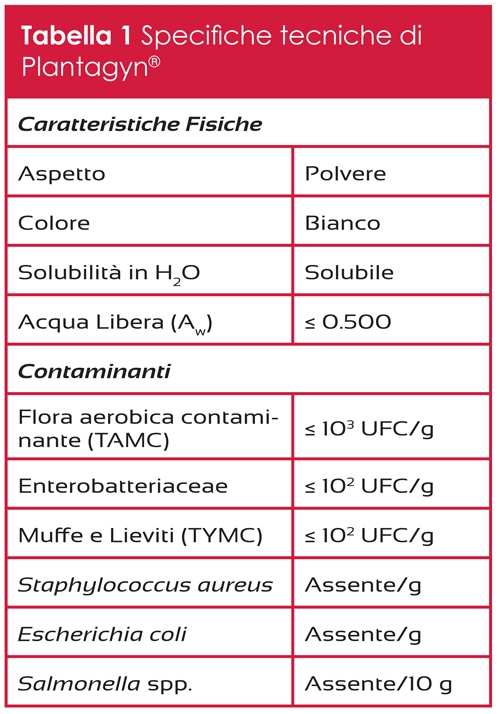
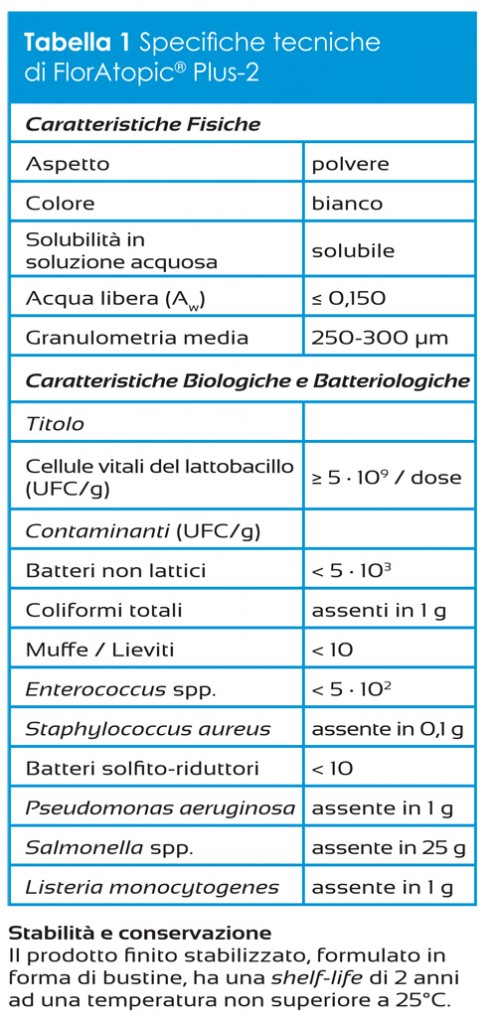
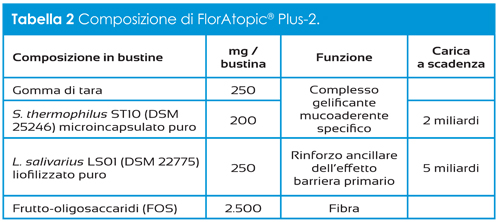
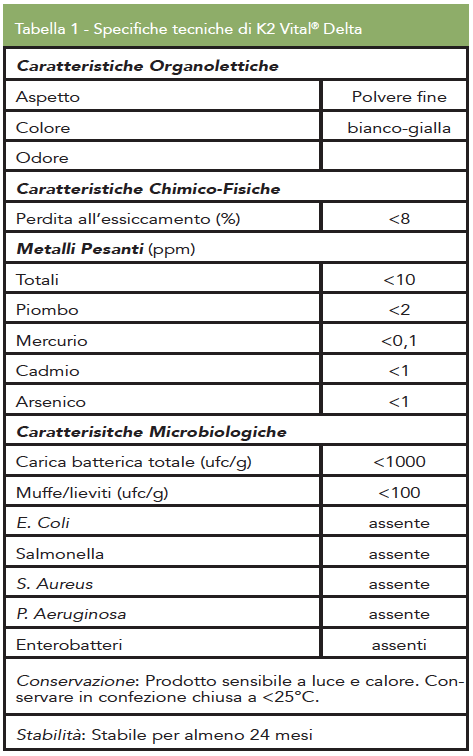
K2 Vital® è un prodotto a base di vitamina K2 ottenuta attraverso un processo sintetico che, rispetto al comune processo fermentativo, garantisce maggiori requisiti in termini di stabilità e purezza, e grazie al quale si ottiene menachinone 7- trans puro. Tale stereoisomeria è molto importante in quanto è l’unica che assicura la corretta interazione con gli enzimi a livello della membrana cellulare, garantendo l’effetto biologico desiderato. Le specifiche tecniche della K2 Vital® Delta, la tipologia di MK-7 indicata per lo sviluppo di integratori, sono riportate in Tabella 1.
Meccanismo d’azione
La vitamina K2 ha una duplice azione, sia a livello osseo che cardiovascolare, in qualità di co-fattore di importanti proteine coinvolte nel metabolismo osseo e nella coagulazione del sangue. Favorisce l’attivazione enzimatica della proteina Gla della matrice (MGP) (vitamina K dipendente), il più potente inibitore del processo di calcificazione tissutale che, attraverso un processo di carbossilazione, lega il calcio prevenendone il deposito a livello della parete vasale. L’eccessiva calcificazione della parete delle arterie infatti rappresenta un fattore di rischio cardiovascolare, poiché oltre ad aumentarne la fragilità e la rigidità, ostacola il normale flusso sanguigno.
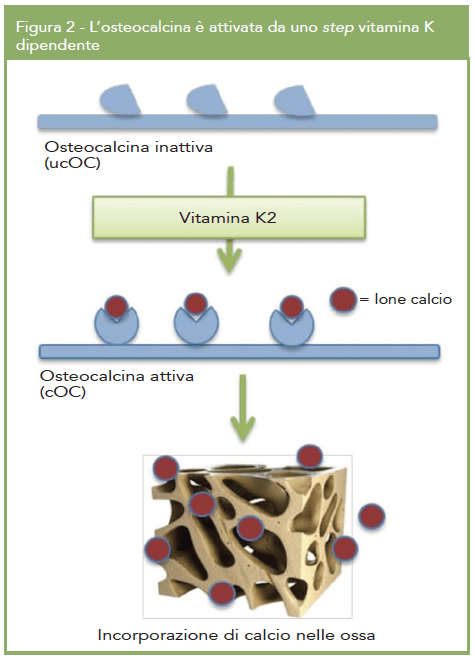
Inoltre gioca un ruolo chiave nell’attivazione dell’osteocalcina, proteina fondamentale nella mineralizzazione ossea, in grado di incorporare il calcio a livello della matrice dell’osso.
L’osteocalcina (OC), principalmente espressa negli osteoblasti e coinvolta nel metabolismo osseo, è strettamente dipendente dalla vitamina K al fine di espletare la sua funzione ed è fondamentale per il mantenimento dell’omeostasi del calcio. Mentre la vitamina D3 induce la sintesi dell’osteocalcina, la vitamina K è coinvolta nella sua attivazione; essa infatti funge da co-fattore dell’enzima in grado di attivare osteocalcina attraverso un processo di carbossilazione in corrispondenza di siti specifici della proteina. Nella forma attivata (carbossilata), OC è in grado di legare il calcio e favorirne il deposito a livello della matrice ossea.
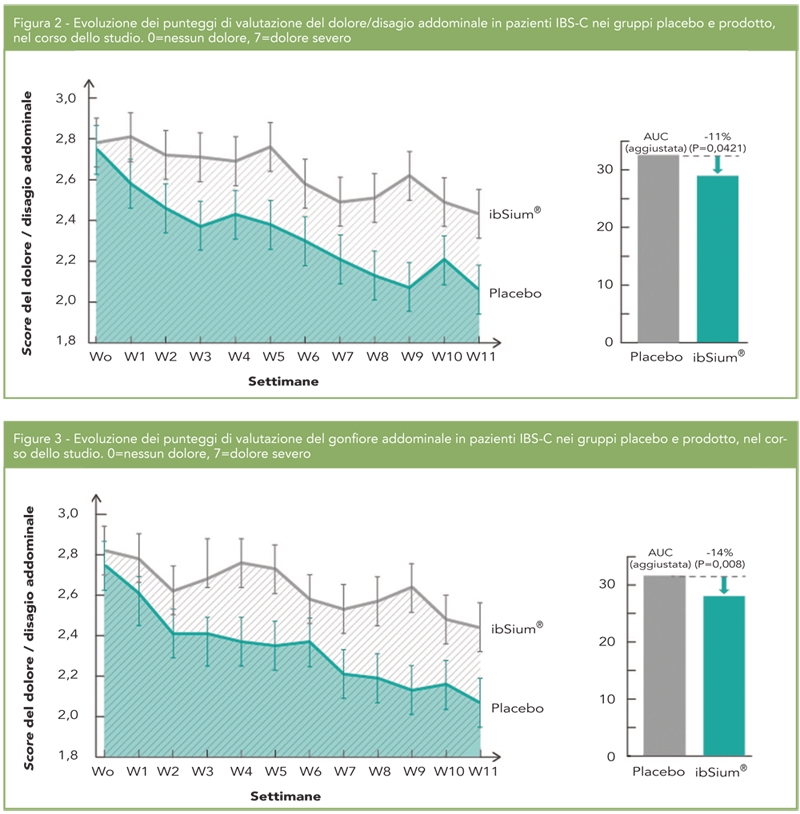
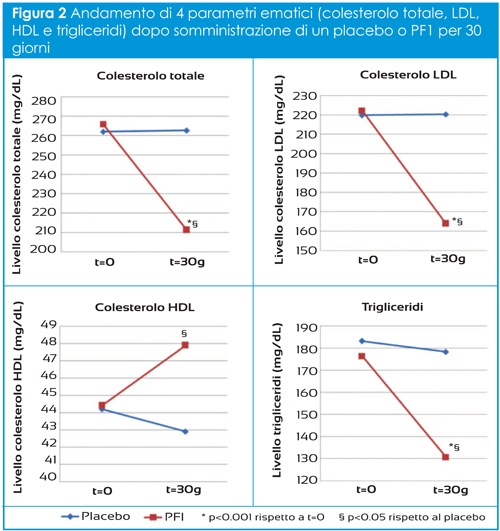
Le frazioni di OC carbossilata (cOC) e inattiva in quanto non carbossilata (ucOC) possono essere misurate al fine di determinare lo stato della vitamina K; individui con un ridotto intake di vitamina K2 presentano una elevata frazione di ucOC che si traduce in una ridotta capacità di legare il calcio. Pertanto elevati livelli sierici di ucOC sono correlati ad una bassa densità minerale ossea (BMD) e ad un elevato rischio di fratture (Fig.2) (2).
Efficacia
L’importanza della vitamina K2 MK-7 per la salute ossea è stata recentemente documentata in soggetti sani.
In uno studio in doppio cieco, randomizzato, sono state reclutate 244 donne di età compresa tra 55 e 65 anni; di queste, 124 sono state assegnate al gruppo di controllo al quale sono state somministrate capsule di placebo e 120 al gruppo trattato con vitamina K2 MK-7. Nel corso dei 36 mesi di studio, al gruppo trattato è stato chiesto di assumere una capsula al giorno, a colazione o a cena, contenente 180 µg di MK-7.
Lo studio è stato condotto in accordo con le linee guida contenute nella Dichiarazione di Helsinki e tutte le procedure che prevedevano il coinvolgimento di soggetti umani sono state approvate dal Comitato Etico Medico dell’Università di Maastricht.
I livelli sierici di ucOC e cOC sono stati determinati; BMC e BMD del collo femorale, dell’anca e della spina lombare (L1-L4) sono stati misurati mediante DEXA al tempo 0 e dopo 12, 24 e 36 mesi. L’assunzione di MK-7 ha significativamente ridotto i livelli di ucOC di circa il 51±21% rispetto al placebo (4±49%), mentre cOC in circolo è aumentata del 21±19%. Lo stato della vitamina K a livello osseo, determinata mediante il rapporto ucOC/cOC, è aumentato del 58±18%. Il massimo effetto sui livelli di OC è stato raggiunto già dopo il primo anno di trattamento e mantenuto nel corso dei successivi due anni. Durante il primo anno la velocità di perdita ossea è risultata simile in entrambi i gruppi; successivamente si è assistito ad una perdita ossea decisamente inferiore nei soggetti trattati con MK-7. Dallo studio è emerso quindi che l’assunzione di MK-7 migliora lo stato di vitamina K e riduce il declino di BMC e BMD correlato all’età, a livello della spina lombare e del collo femorale, mentre non sono state registrate differenze significative a livello dell’anca (3).
Sicurezza
La sicurezza di MK-7 è stata valutata mediante un test di tossicità in fase acuta condotto su topi e in uno studio di tossicità subcronica in ratti in seguito a somministrazione orale giornaliera del prodotto per un periodo di 90 giorni. Dallo studio di tossicità acuta è emerso che al dosaggio limite di 2000 mg/kg di peso corporeo, MK-7 non ha indotto alcun segno di tossicità in nessuno dei topi trattati con tale dose per tutto il periodo di osservazione della durata di 14 giorni. Inoltre non si è verificata alcuna influenza sul peso corporeo dei topi trattati. Sulla base di questi risultati e sotto le condizioni di tale studio, la dose letale media (LD50) di MK-7 è risultata essere di gran lunga superiore rispetto alla dose limite di 2000 mg/kg. Allo stesso modo il test di tossicità subcronica non ha prodotto alcun caso di mortalità e non sono stati evidenziati segni clinici di tossicità sistemica alla dose di 10 mg/kg peso corporeo/giorno (4).
Applicazioni e Modalità d’uso
In EU la dose giornaliera raccomandata di vitamina K è pari a 75 µg/giorno e questa è necessaria per l’attivazione dei fattori di coagulazione a livello sanguigno. Nei soggetti sani l’intake di vitamina K dal cibo è sufficiente per attivare completamente i fattori di coagulazione a livello epatico. Per quanto riguarda la vitamina K2 alcuni dati pubblicati recentemente riportano che un dosaggio nel range di 90-120 µg/giorno aiuta a ridurre la quantità di ucOC in circolo (5). K2 Vital® è indicato per lo sviluppo di diverse forme farmaceutiche come ad esempio compresse, capsule, soft gel, bustine.
Bibliografia
1 L.J. Schurgers, C. Vermeer (2000)
Determination of phylloquinone and menaquinones in food. Effect of food matrix on circulating vitamin K concentrations Haemostasis 30 298-307
2 P. Szulc, M.C. Chapuy, P.J. Meunier, P.D. Delmas (1993)
Serum undercarboxylated osteocalcin is a marker of the risk of hip fracture in elderly women J Clin Invest 91(4) 1769-1774
3 M.H.J. Knapen, N.E. Drummen, E. Smit, C. Vermeer, E. Theuwissen (2013) Three-year low-dose menaquinone-7 supplementation helps decrease bone loss in healthy postmenopausal women
Osteoporosis Int 24(9) 2499-2507
4 K. Pucaj, H. Rasmussen, M. Moller, T. Preston (2011)
Safety and toxicological evaluation of a synthetic vitamin K2, menaquinone-7
Toxicol Mech Methods 21(7) 520–532
5 E. Theuwissen, E.C. Cranenburg, M.H. Knapen et al (2012)
Low-dose menaquinone-7 supplementation improved extra-hepatic vitamin K status, but had no effect on thrombin generation in healthy subjects
Br J Nutr 31 1-6
Per informazioni
Giusto Faravelli SpA – Divisione Nutraceutica
dietetico@faravelli.it
www.faravelli.it
Faravelli in a nutshell
Giusto Faravelli SpA è la casa madre del Gruppo Faravelli. L’attività del gruppo è incentrata sulla distribuzione di materie prime per i settori dietetico-nutraceutico, alimentare, cosmetico, farmaceutico, industriale, efficacemente supportata da un ampio ventaglio di servizi sinergici, in costante evoluzione ed ampliamento. Provenienti da fornitori accuratamente selezionati in tutto il mondo, le materie prime proposte all’industria nutraceutica comprendono Sali minerali, eccipienti, lieviti, antiossidanti, aminoacidi, zuccheri e derivati, dolcificanti, vitamine, proteine, fibre, acidi grassi, estratti vegetali, estratti in polvere, attivi per il controllo del peso e del colesterolo, attivi per il sistema immunitario, carotenoidi naturali, attivi ad azione antinfiammatoria.