Riassunto
Gli α-Galattoligosaccaridi (α-GOS) sono una fibra solubile innovativa ottenuta dai piselli, costituita da unità saccaridiche connesse da legami α e che si differenzia dai GOS tradizionali per l’origine vegetale e per l’assenza di allergeni del latte. Questo ingrediente, il cui processo di produzione è brevettato, è stato valutato in studi pre-clinici e clinici sia per il potenziale bifidogenico, sia per un altro effetto salutistico, ovvero la capacità di indurre sensazione di sazietà attraverso meccanismi diversi da quelli caratteristici delle fibre insolubili. Il quadro emergente è di un prodotto sicuro, dal chiaro carattere prebiotico e con interessanti prospettive nell’ambito del controllo dell’appetito e del weight management.
Introduzione
I galattoligosaccaridi (GOS) sono oligosaccaridi (polisaccaridi a corta catena) costituiti da unità di glucosio e galattosio, solitamente caratteristici del latte e da cui vengono anche usualmente ottenuti per produzione industriale. In ambito nutraceutico appartengono alla categoria delle fibre solubili ovvero fibre che, al contrario delle comuni fibre alimentari, è possibile sciogliere completamente in acqua. I GOS non vengono degradati dagli enzimi digestivi dell’intestino e giungono indigeriti nel colon dove vengono fermentati dal microbiota residente, principalmente dalla popolazione di bifidobatteri, che li utilizza come fonte di carbonio.
Attraverso questa funzione bifidogenica i GOS svolgono un’attività prebiotica e trofica della flora batterica residente, promuovendone uno stato normale, incrementando la massa fecale e stimolando quindi la regolare funzione intestinale (1).
Recentemente è stata sviluppata una versione innovativa di GOS: tale versione consiste nei cosiddetti α-GOS ed è costituita da galattoligosaccaridi a 2, 3 e 4 unità (un glucosio legato a 1, 2 o 3 molecole di galattosio, rispettivamente denominati melibiosio, manninotriosio e verbascotetraosio) in cui le unità costitutive sono connesse tra loro da legami di tipo alfa-glicosidico. Gli α-GOS sono ottenuti mediante un processo brevettato da una fonte interamente vegetale, ovvero i comuni piselli di campo (Pisum sativum L.), dall’azienda francese Olygose, e distribuiti in Italia da C.F.M. Co. Farmaceutica Milanese. Gli α-GOS rappresentano quindi un’alternativa vegetale ai comuni GOS largamente diffusi sul mercato, vantando assenza di allergeni e possibilità di essere consumati anche dalla popolazione vegana. Con i GOS tradizionali, gli α-galattoligosaccaridi condividono invece l’ottima solubilità in acqua, l’indigeribilità da parte dell’intestino umano e quindi la fermentabilità da parte del microbiota intestinale e la funzione bifidogenica; come la versione di origine lattica possono quindi essere utilizzati come fibra solubile in un’ampia gamma di formulazioni prebiotiche e simbiotiche.
Oltre a dette caratteristiche, vi sono evidenze che le fibre solubili, analogamente a quelle insolubili, siano in grado di influire sul senso di sazietà e di conseguenza sull’introito calorico; un tale effetto si configura potenzialmente come un importante contributo nel controllo del peso corporeo in un contesto di penetrazione sempre più diffusa dell’obesità, sia nei paesi sviluppati sia in paesi in via di sviluppo.
Diversamente dalle fibre insolubili, che concorrono ad un aumento della sensazione di sazietà attraverso diversi meccanismi, quali una ridotta densità energetica degli alimenti che le contengono, una maggiore necessità di masticazione e una maggiore distensione gastrica e attraverso un prolungamento del tempo di svuotamento dello stomaco, l’interazione tra fibre solubili e senso dell’appetito non sarebbe spiegabile allo stesso modo, bensì sarebbe mediato dall’azione del microbiota intestinale. Recentemente si sta investigando la relazione tra la flora intestinale e l’obesità; in particolare la produzione di acidi grassi a catena corta (SCFA) sembra poter influenzare la secrezione di ormoni peptidici da parte dell’apparato gastrointestinale (2), responsabili poi della regolazione dell’appetito.
Nella presente pubblicazione vengono quindi valutati il potenziale bifidogenico, l’interazione con il microbiota e i possibili effetti di moderazione dell’appetito degli α-galattoligosaccaridi, sia in esperimenti pre-clinici in vitro e in modelli animali, sia in test nell’uomo per somministrazione di α-GOS* come integratore alimentare a soggetti volontari.
Materiali e metodi
Studi pre-clinici
Gli esperimenti di coincubazione con fibre prebiotiche sono stati effettuati aggiungendo le diverse fibre a microbiota fecale umano (di soggetti adulti, obesi e magri in tre ripetizioni o di neonati, in 6 ripetizioni) ad una concentrazione di 4mg/mL per un tempo di coltura di 24 ore. Il DNA batterico è stato isolato ed estratto attraverso un kit commerciale di purificazione (AGOWA mag Mini DNA Isolation Kit AGOWA, LGC genomics, Germany) e successivamente sottoposto ad amplificazione per qPCR e sequenziamento per quantificare e identificare la popolazione microbica. Il medium di co-incubazione è stato anche sottoposto ad analisi HPLC per l’identificazione e la quantificazione di acidi grassi a corta catena (SCFA, acetato, propionato, butirrato, isobutirrato). I campioni di microbiota infantile sono anche stati sottoposti a spiking con Clostridium difficile per valutare un eventuale effetto inibitorio sul batterio da parte delle fibre prebiotiche: clostridio e fibre/controllo sono stati co-incubati con il microbiota fecale per 24 ore (6 ripetizioni per ciascuna condizione) e al termine dell’incubazione le copie di genoma batterico del clostridio sono state enumerate, sempre mediante tecnica qPCR.
La sicurezza e il potenziale bifidogenico degli α-GOS sono stati confermati in un test in vivo condotto in maialini da latte, un modello animale utilizzato per la valutazione di alimenti nella popolazione neonatale: a 2 gruppi da 12 animali pre-svezzamento è stata somministrata quotidianamente una formula contenente 8 g/L di α-GOS o un controllo. Il trattamento, condotto in condizioni di stabulazione controllate, ha avuto una durata di 3 settimane a partire dal momento in cui gli animali hanno raggiunto 1,5 kg di peso. Durante il periodo di trattamento gli animali sono stati monitorati per crescita, consumo di cibo, mortalità e segnali clinici anormali. Alla fine del trattamento è stata valutata la popolazione microbica fecale, misurando attraverso qPCR il contenuto di bifidobatteri e lattobacilli in campioni di feci e le eventuali differenze tra popolazione trattata e di controllo. Gli animali sono stati infine sacrificati e il sangue e i tessuti raccolti e valutati per eventuali anomalie cliniche.
Studi clinici
La caratterizzazione della popolazione di bifidobatteri fecali nello studio nell’uomo è stata effettuata come descritto altrove (3). In breve è stato prima estratto il DNA batterico attraverso kit commerciale (Stool Mini Kit, Qiagen) a seguito di preparazione chimica e meccanica dei campioni; la quantificazione è stata effettuata mediante PCR real-time quantitativa, attraverso l’uso di primer specifici per il genus dei Bifidi.
Per lo studio sulla relazione tra assunzione di α-GOS e appetito, 88 volontari in lieve sovrappeso sono stati divisi in 4 gruppi. Ciascun gruppo ha ricevuto due volte al giorno per due settimane una bevanda non zuccherata contenente un placebo o 3, 6 o 9 g di α-GOS disciolti, per un totale di 6, 12 o 18 g/die.
L’endpoint primario dello studio è stata la valutazione dell’appetito sulla base di 5 parametri: fame, sensazione di pienezza, sazietà, consumo potenziale e desiderio di mangiare. Le sensazioni sono state valutate e confrontate tra loro attraverso scale VAS (Visual Analog Scales) nel contesto di due momenti di test distinti, al giorno 0 e alla fine del periodo di somministrazione al giorno 15. Ciascun test della durata complessiva di 480 minuti ha previsto la valutazione di ciascuna sensazione ogni 60 minuti; al t0 e al t=240 minuti sono stati consumati rispettivamente una colazione e un pasto standard. La curva di percezione nel tempo di ciascuna sensazione è stata quantificata calcolandone l’Area sotto la Curva (AUC); l’area della curva al giorno 0 è stata poi confrontata con quella al giorno 15 per valutare l’impatto sull’appetito del trattamento di 15 giorni con α-GOS. L’introito di cibo e calorie è stato calcolato conteggiando con precisione il cibo effettivamente assunto nel pasto standard di ciascuno dei due giorni di test.
Per la valutazione dei livelli di lipopolisaccaride (LPS) plasmatico, è stato condotto un prelievo sanguigno a digiuno al giorno 0 e 15 in provette apirogene con EDTA; dopo la conservazione a -70°C la misura è stata effettuata con kit cromogenico Limulus Amebocyte Lysate HIT302 (Hycult).
Risultati
Studi pre-clinici
La quantificazione (espressa in copie di DNA/g misurate attraverso PCR quantitativa) dei bifidobatteri nel microbiota di neonati (ottenuto da campioni fecali) incubato con α-GOS, beta-GOS, 2-fucosil-lattosio, inulina e con un controllo negativo (Fig.1), ha evidenziato per incubazione con α-GOS un incremento rispetto al trattamento con il controllo e livelli paragonabili con quelli ottenuti con beta-GOS, fibra prebiotica comunemente utilizzata. È anche interessante osservare che il potenziale bifidogenico e l’incremento dell’abbondanza relativa dei bifidi, ascrivibile al trattamento con α-GOS e altri prebiotici, ha anche provocato un’inibizione della crescita di C. difficile (noto agente causativo di fenomeni diarroici soprattutto nei neonati) quando co-incubato nelle stesse colture in vitro. Simili esperimenti sono stati condotti co-incubando microbiota ottenuto da campioni fecali di soggetti adulti, sia magri che obesi (dati non mostrati); in questo esperimento si è osservato un comparabile incremento di circa due logaritmi della conta di bifidi ad opera di α-GOS e beta-GOS (circa 106 copie DNA/mL) rispetto al controllo (circa 104 copie DNA/mL). Inoltre la misurazione cromatografica dei livelli di acidi grassi a catena corta negli stessi campioni di feci precedentemente co-incubate con diversi tipi di fibre alimentari ha mostrato che acetato e butirrato erano quelli alle concentrazioni mediamente più elevate. Sia in soggetti magri che in soggetti obesi l’incubazione con α-GOS ha sempre determinato un incremento significativo di acetato e butirrato rispetto al controllo non incubato, evidenziando effetti paragonabili a quelli ottenuti con un oligosaccaride di riferimento come beta-GOS.
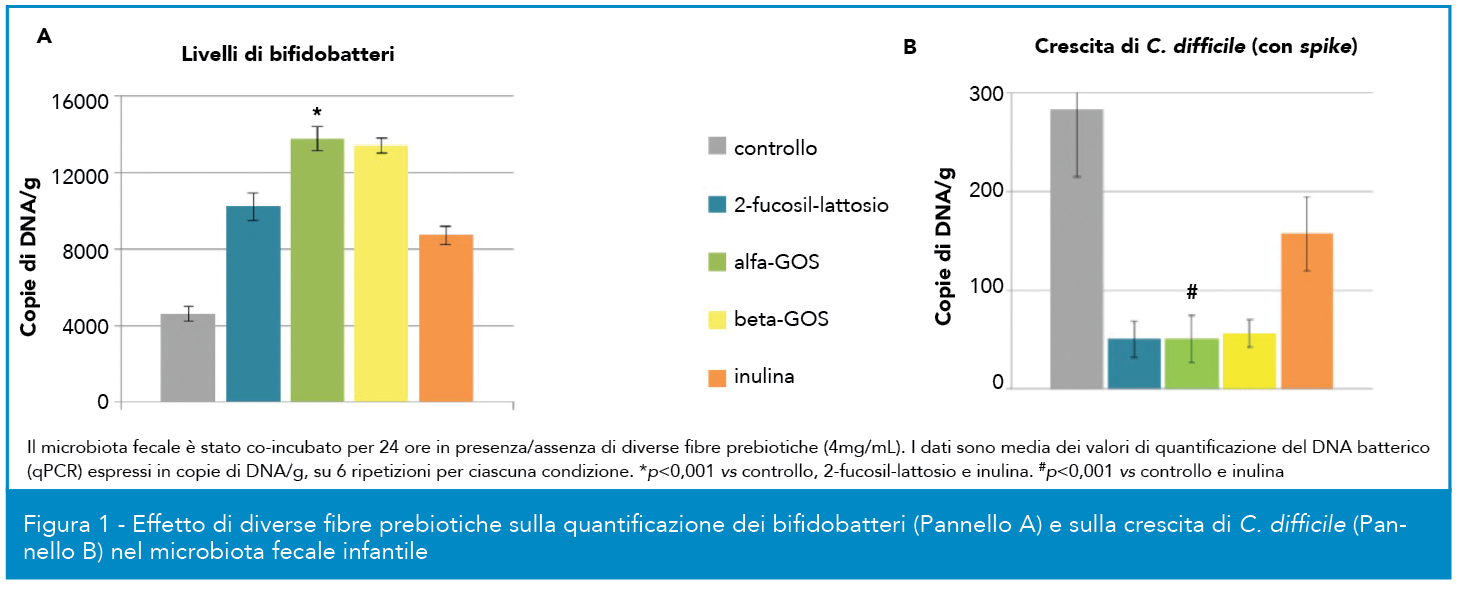
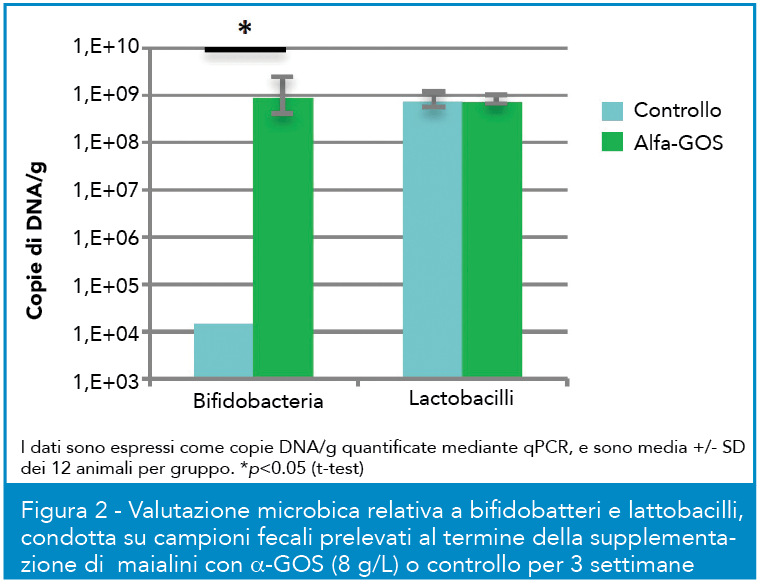
Gli α-GOS sono stati anche valutati in un test in vivo in maialini da latte pre-svezzamento. Gli endpoint principali dello studio sono stati l’esame della sicurezza del trattamento per gli animali, ovvero eventuali differenze in termini di crescita e di incidenza di fenomeni clinici anomali tra animali trattati e non, e la valutazione del potenziale bifidogenico e l’effetto sull’apparato gastrointestinale. Il consumo di α-GOS con formula non ha provocato differenze significative nel peso corporeo e nel tasso di aumento dello stesso e nell’assunzione di cibo rispetto al controllo; anche la feed efficiency, ovvero la misura dell’efficienza in accrescimento dell’animale in base alla quantità di cibo consumato, è risultata paragonabile (16% per α-GOS contro 15,1% controllo, differenza non significativa). È stato riportato un numero superiore di casi di diarrea in animali alimentati con formula addizionata (11 contro 3, nelle tre settimane), ma la maggior parte dei casi si è verificata nella prima settimana. In Figura 2 si può osservare come il trattamento con α-GOS abbia incrementato significativamente la popolazione di bifidi rispetto al controllo, a fronte di un sostanziale bilanciamento dei gruppi al t0, mentre non vi è stato effetto sulla frazione di lattobacilli. Si è anche osservato un incremento significativo del microbiota totale nei trattati rispetto al controllo, oltre ad un pH inferiore, un peso superiore del cieco-colon e un livello più elevato di acetato e propionato nel colon (dati non mostrati).
Studi clinici
L’effetto bifidogenico degli α-GOS è stato anche valutato nell’uomo: un primo test è stato condotto su un totale di 88 soggetti, volto a rilevare eventuali differenze tra oligosaccaridi a crescente grado di polimerizzazione (2, 3 o 4 unità saccaridiche) in relazione all’effetto sull’organismo. Dopo due settimane di somministrazione quotidiana di 12 g di ciascun tipo di fibra, tutte e tre le formulazioni hanno provocato nei soggetti un incremento significativo della conta di bifidobatteri fecali rispetto al t0 (circa +8,5%), al contrario del ramo del placebo che è risultato indistinguibile (differenza significativa tra ramo placebo e ciascuno dei tre trattamenti a t=15d, p<0,05). Le tre formulazioni non hanno invece evidenziato differenze significative tra loro; le quattro coorti dello studio non erano distinguibili al t0. Al contrario di quanto osservato nella popolazione di bifidobatteri, la conta complessiva batterica fecale non ha mostrato differenze al termine dello studio. Si segnala che anche al termine di un altro studio interventistico nell’uomo, condotto per somministrazione di α-GOS (12 g/die) o di un placebo ad un totale di 98 persone per 4 settimane, si è osservato un arricchimento significativo della popolazione di bifidi del microbiota.
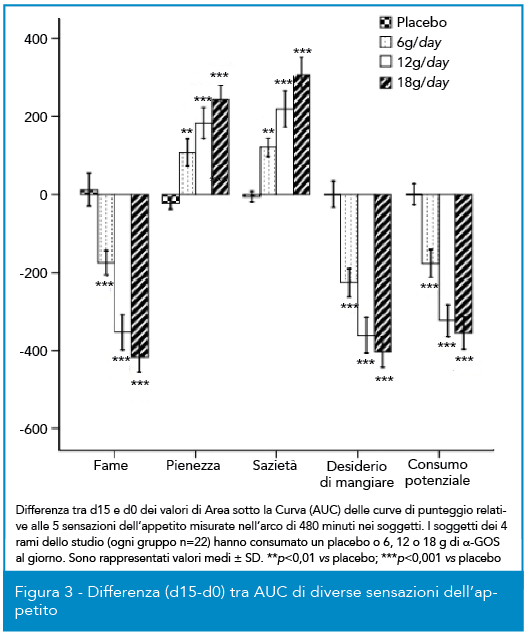
In una diversa valutazione clinica, anch’essa condotta su 88 soggetti divisi in quattro rami, un placebo e tre dosi crescenti di α-GOS (dose giornaliera di 6, 12 o 18 g disciolti in una bevanda non zuccherata in due somministrazioni) sono state somministrate a volontari sani, questa volta con lo scopo di valutare l’impatto di questa fibra prebiotica solubile sull’appetito. La misura è stata fatta confrontando i dati al t0 e al t=15d dopo due settimane di somministrazione, come valutazione di 5 differenti sensazioni secondo una scala VAS (Visual Analogue Scale). La Figura 3 mostra la differenza tra t0 e t= 15d della misura delle 5 sensazioni in un arco temporale di 480 minuti (area sotto la curva); è possibile osservare come il placebo non abbia mai prodotto differenze mentre, al contrario, per i soggetti che sono strati integrati con α-GOS si sono rilevati aumenti significativi delle sensazioni di sazietà e pienezza e delle riduzioni significative delle sensazioni di fame, consumo potenziale e desiderio di mangiare; per le variazioni rilevate si è anche osservato un interessante trend dose/risposta, ove il dosaggio ottimale appare essere rappresentato da 12 g/die.
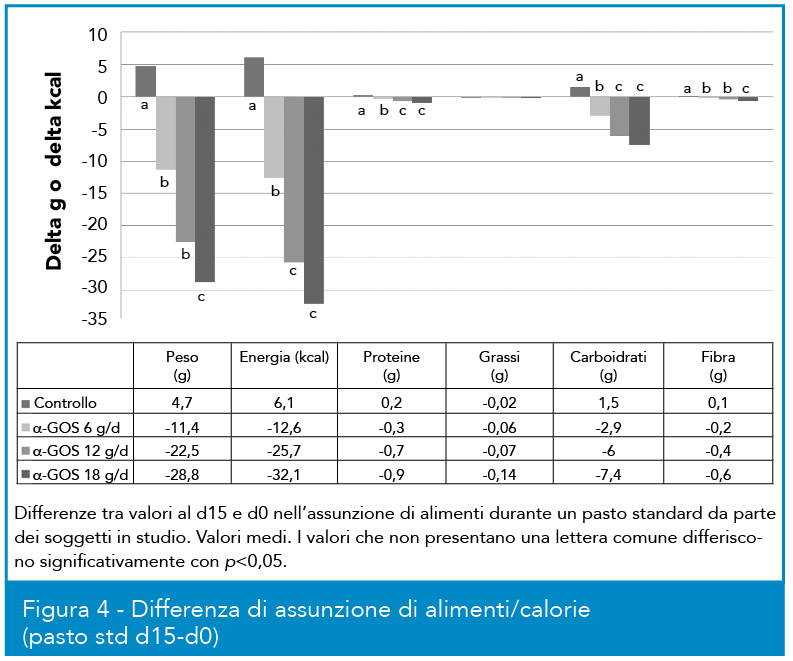
In Figura 4 è illustrato come l’assunzione per due settimane di α-GOS possa anche essere correlata con una riduzione della quantità di cibo e di calorie assunti durante un pasto test. La figura mostra il delta di introito di diversi alimenti e calorie tra due pasti standard consumati a t0 e t=15d; ancora una volta il controllo con placebo non risulta influenzato positivamente, mentre il trattamento con prebiotico mostra una riduzione significativa di assunzione di alcuni nutrienti e calorie, con un interessante trend dose/risposta.
Nello stesso studio è stato misurato anche il lipopolisaccaride (LPS) plasmatico, un’endotossina indicatrice di uno stato infiammatorio sistemico. In accordo con altri studi in merito al ruolo modulatorio dell’infiammazione da parte dei prebiotici (4,5), il trattamento per due settimane con α-GOS ha comportato una riduzione significativa dei livelli di LPS plasmatico, con un effetto più marcato alle dosi più elevate (approssimativamente -50% tra controllo e trattamento con 12 g/die, dati non mostrati) mentre i gruppi non differivano significativamente alla baseline.
Discussione e Conclusioni
Le fibre sono un alimento importante nel contesto di una corretta alimentazione per l’uomo; le fibre insolubili contribuiscono a incrementare la massa fecale e a regolarizzare l’alvo, ma un ruolo importante è riconosciuto anche alle fibre solubili, che si distinguono per la loro attività prebiotica, ovvero di sostegno della crescita del microbiota residente nell’intestino. Un corretto apporto di prebiotici è necessario e benefico negli adulti ed è anche pratica comune nei neonati, in particolare come complemento in caso di alimentazione con formule artificiali, per simulare gli oligosaccaridi naturalmente presenti nel latte materno. Gli α-GOS sono una fibra alimentare innovativa, recentemente ottenuta attraverso un procedimento produttivo brevettato; rappresentano un’alternativa ai comuni GOS (beta-GOS) ottenuti a partire dal latte e offrono il vantaggio di avere origine vegetale poiché ottenuti dai piselli per separazione dal cosiddetto pea-whey, la componente da cui è anche estratta la frazione proteica per altre applicazioni nutraceutiche.
Diversi esperimenti in vitro sono stati dedicati alla valutazione del potenziale di stimolazione della flora microbica, in particolare del genere Bifidobacterium, da parte degli α-GOS; i test sono stati condotti su microbiota ottenuto da campioni fecali sia di adulti che di neonati, co-incubando la flora batterica con diverse fibre prebiotiche ed in entrambi i casi si è osservata una stimolazione significativa del pool di bifidi, in termini paragonabili o superiori all’effetto ottenuto con altre fibre solubili, in particolare con beta-GOS tradizionali. Si riscontra quindi che i bifidobatteri sono in grado di fermentare gli α-GOS e questo è stato anche confermato nello studio con microbiota di adulti, monitorando i livelli di produzione degli acidi grassi a corta catena (SCFA), principali by-products degli eventi fermentativi e considerati molecole importanti anche per il benessere dell’apparato gastrointestinale, del sistema immunitario e dell’organismo nel suo complesso (6,7). Nello studio in vitro condotto su microbiota di neonati si è anche riscontrato un interessante effetto di inibizione della crescita del clostridio dopo spiking dello stesso nella co-coltura, probabilmente per competizione con le specie microbiche benefiche.
Lo studio in maialini da latte pre-svezzamento, volto a confermare la sicurezza degli α-GOS anche in un modello animale che simula l’utilizzo dei nutrienti nella sotto-popolazione umana dei neonati, ha offerto un quadro di sostanziale efficacia e sicurezza in tre contesti importanti: gli animali sono andati incontro ad uno sviluppo del tutto paragonabile a quello degli animali di controllo, alimentandosi adeguatamente; non si sono osservati eventi clinici di rilievo, né una maggiore incidenza di eventi avversi che destassero preoccupazione; è stato confermato il ruolo di stimolazione della sotto-popolazione di bifidi dell’intestino, per analisi del microbiota fecale. I dati preclinici evidenziano quindi per gli α-GOS un potenziale benefico, che posiziona questa fibra solubile prebiotica innovativa ad un livello comparabile con la controparte tradizionale di origine lattica, aprendo le porte per un utilizzo come agente prebiotico, sia in integrazione per adulti, sia come complemento in formule infant. Anche lo studio condotto nell’uomo ha permesso di riscontrare un significativo effetto bifidogenico come conseguenza della somministrazione di α-GOS come integrazione della dieta quotidiana. L’endpoint principale dello studio era tuttavia l’investigazione di un altro possibile effetto, ovvero la regolazione dell’appetito, coerentemente con simili evidenze disponibili in letteratura (8): la somministrazione per due settimane di fibre solubili α-GOS ha permesso di osservare una riduzione dell’appetito secondo una relazione dose risposta, oltre ad una diminuzione dell’introito calorico e di alimenti in corrispondenza di un pasto standard. La regolazione dell’appetito da parte di alimenti specifici, qui misurata valutando 5 distinte sensazioni secondo una metodologia largamente utilizzata, potrebbe rappresentare un interessante approccio anche per aumentare la probabilità di ottenere risultati positivi nel contesto di programmi di riduzione controllata del peso. Il meccanismo proposto per questo effetto è che sia l’interazione tra flora intestinale e tessuti, mediata in particolare dai metaboliti fermentativi batterici quali gli acidi grassi a corta catena (SCFA), a influire sull’appetito, modulando la secrezione di peptidi ormonali come grelina (oressigenico) e GLP-1/PYY (anoressizzanti) da parte dell’apparato gastrointestinale (9). Inoltre la riduzione dell’infiammazione sistemica rappresenta un potenziale beneficio rilevante per l’organismo, anche in relazione alla nutrizione e alle problematiche correlate (es. sindrome metabolica); quanto osservato nello studio, ovvero una diminuzione significativa dell’endotossina sistemica plasmatica LPS, può essere un ulteriore risultato indirettamente riconducibile al ruolo del microbiota attraverso la normalizzazione dell’effetto barriera promosso e supportato da un migliore stato di salute della flora microbica intestinale.
Sempre in relazione al potenziale salutistico degli α-GOS, l’Autorità Europea per la sicurezza alimentare EFSA ha approvato due rivendicazioni che riguardano i GOS: (i) contribuiscono alla corretta mineralizzazione dei denti e (ii) utilizzati in alimenti in sostituzione di carboidrati digeribili, contribuiscono ad una riduzione della glicemia post-prandiale, rispetto al consumo di alimenti contenenti zucchero. Gli α-GOS, in quanto galactoligosaccaridi non digeribili, possono vantare le stesse rivendicazioni, come concluso da specifiche opinoni di EFSA dedicate all’argomento (10,11). In conclusione, grazie al potere bifidogenico e al potenziale di regolazione dell’appetito, entrambi effetti documentati dai dati scientifici presentati, gli α-galattoligosaccaridi rappresentano un’interessante nuova frontiera nel campo dell’integrazione con fibre prebiotiche solubili.
Bibliografia
1. Niittynen L, Kajander K, Korpela R (2007) Galacto-oligosaccharides and bowel function. Scand J Food Nutr 51:62–66
2. Tolhurst G, Heffron H, Lam YS et al (2012) Short-chain fatty acids stimulate glucagon-like peptide-1 secretion via the G-protein-coupled receptor FFAR2. Diabetes 61:364-371
3. Fança-Berthon P, Hoebler C, Mouzet E, David A, Michel C (2010) Intrauterine growth restriction not only modifies the cecocolonic microbiota in neonatal rats but also affects its activity in young adult rats. J Pediatr Gastroenterol Nutr 51:402-413
4. Pourghassem Gargari B, Dehghan P, Aliasgharzadeh A, Asghari Jafar-Abadi M (2013) Effects of high performance inulin supplementation on glycemic control and antioxidant status in women with type 2 diabetes. Diabetes Metab J 37:140-148
5. Vulevic J, Juric A, Tzortzis G, Gibson GR (2013) A mixture of trans-galactooligosaccharides reduces markers of metabolic syndrome and modulates the fecal microbiota and immune function of overweight adults. J Nutr 143:324-331
6. Baothman OA, Zamzami MA1, Taher I et al (2016) The role of Gut Microbiota in the development of obesity and Diabetes. Lipids Health Dis 15:108
7. Boulangé CL, Neves AL, Chilloux J et al (2016) Impact of the gut microbiota on inflammation, obesity, and metabolic disease. Genome Med 8:42
8. Cani PD, Lecourt E, Dewulf EM et al (2009) Gut microbiota fermentation of prebiotics increases satietogenic and incretin gut peptide production with consequences for appetite sensation and glucose response after a meal. Am J Clin Nutr 90:1236-1243
9. Clarke G, Stilling RM, Kennedy PJ et al (2014) Minireview: Gut microbiota: the neglected endocrine organ. Mol Endocrinol 28:1221-1238
10. EFSA Panel on Dietetic Products, Nutrition and Allergies (2014) Scientific Opinion on the substantiation of a health claim related to AlphaGOS® and a reduction of post-prandial glycaemic responses pursuant to Article 13(5) of Regulation (EC) No 1924/2006. EFSA J 12(10):3838, 10 pp
11. EFSA Panel on Dietetic Products, Nutrition and Allergies (2013) Scientific Opinion on the substantiation of a health claim related to “non-fermentable”carbohydrates and maintenance of tooth mineralisation by decreasing tooth demineralisation pursuant to Article 13(5) of Regulation (EC) No 1924/2006. EFSA J 11(7):3329, 13 pp
*AlphaGOS®, prodotto da Olygose e distribuito in Italia da C.F.M. Co.Farmaceutica Milanese • francesco.zerilli@cofamispa.it

