Mitochine
Mitochine
Nuovo target per un’innovativa strategia antinquinamento
Mélanie Mangier, David Boudier, Marine Laclaverie, Audrey Bonnefoy, Sylvie Bordes, Brigitte Closs
R&D department, SILAB
Parole chiave
Mitochine • Inquinamento • Comunicazione cellulare • Funzione barriera
Mitokines
New target for an innovative antipollution strategy
Summary
Mitokines, authentic recently identified mitochondrial sentinels, are the basis of cellular communication and defense strategy to combat stress. The increasing and daily exposure to pollution has harmful effects on health, in particular by destroying skin homeostasis. The skin is suffocated, dehydrated, opaque and ages prematurely. The prohibitines (PHB) are essential mitokines widely studied in basic research and especially in reference to lung diseases related to pollution.
However, no scientific evidence has established the role of mitokines in a context of skin pollution. Having first identified the aryl hydrocarbon receptor (AhR) as the target of the pollutants that attack the skin, a two-stage model was created in vitro, used to determine the role and study the mitokines regulation mechanisms at the cutaneous level. In a first phase, human keratinocytes were subjected to hypoxic stress (treatment with Cobalt) or exposed to pollutants (benzo [a] pyrene and particulate matter) and a significant reduction in PHB synthesis was detected. Subsequently, a reconstructed recurrent epidermis model in mitokines revealed the key role of PHB in the formation of a functional epidermal barrier, demonstrating that restoring the mitokines capital in the skin will be of primary interest for future antipollution cosmetic strategies.
Riassunto
Le mitochine, autentiche sentinelle mitocondriali recentemente identificate, sono alla base della comunicazione cellulare e della strategia di difesa per combattere lo stress. La crescente e giornaliera esposizione all’inquinamento ha effetti dannosi sulla salute, in particolare distruggendo l’omeostasi cutanea. La pelle è soffocata, disidratata, opaca e invecchia prematuramente. Le proibitine (PHB) sono mitochine essenziali ampiamente studiate in ricerca di base e soprattutto in riferimento alle patologie polmonari correlate all’inquinamento.
Tuttavia, nessuna evidenza scientifica ha stabilito il ruolo delle mitochine in un contesto di inquinamento cutaneo. Dopo aver primariamente identificato il recettore arilico per gli idrocarburi (AhR) come bersaglio degli inquinanti che aggrediscono la pelle, è stato creato un modello a due stadi in vitro, utilizzato per determinare il ruolo e studiare i meccanismi di regolazione delle mitochine a livello cutaneo. In una prima fase, i cheratinociti umani sono stati sottoposti a stress ipossico (trattamento con cobalto) o esposti a inquinanti (benzo[a]pirene e particolato) ed è stata rilevata una significativa riduzione della sintesi di PHB. Successivamente, un modello di epidermide ricostruita deficitario in mitochine ha rivelato il ruolo chiave delle PHB nella formazione di una barriera epidermica funzionale, dimostrando che ristabilire il capitale di mitochine nella pelle sarà di primario interesse per le future strategie cosmetiche antinquinamento.
Introduzione
Il sempre crescente trend globale verso l’urbanizzazione ha reso l’inquinamento il fattore ambientale di maggiore impatto sulla salute pubblica. Per rispondere a questa problematica, la ricerca si è focalizzata sempre più sugli effetti dannosi dell’inquinamento sulla salute umana, come dimostrato dal crescente numero di pubblicazioni sull’argomento, raddoppiate in meno di una decade (1,2). Tuttavia, solo pochi studi si sono focalizzati sull’impatto dell’inquinamento sulla pelle, nonostante quest’ultima sia la prima barriera biologica all’inquinamento esterno. Dato che le capacità di difesa della pelle non sono illimitate, l’inquinamento deteriora l’integrità della barriera cutanea e dunque la sua omeostasi.
Gli inquinanti, composti organici e inorganici tra cui ozono, particolato (PM), idrocarburi policiclici aromatici (PAH), metalli pesanti, fumo di sigaretta, sono ampiamente riconosciuti come dannosi per la salute (1,3,4). Alcuni inquinanti lipofili, soprattutto il PM e il PAH benzo[a]pirene, penetrano la membrana cellulare e si accumulano nei mitocondri, causando uno stress ossidativo a livello cutaneo. Quando i lipidi dello stratum corneum (SC) vengono ossidati, il risultato è una disfunzione della funzione barriera (5,6) che rende l’incarnato opaco e spento (7). Inoltre, un ambiente inquinato comporta un rimodellamento della matrice extracellulare che causa un prematuro invecchiamento cutaneo con la comparsa di rughe e macchie scure (5). Infine, oltre al disagio psicosociale causato da questi disordini cutanei, possono comparire o essere esacerbate patologie come eczema, acne, dermatite atopica, psoriasi, eritemi, edemi e neoplasie (8).
Oltre a essere un componente essenziale per la produzione di energia cellulare, il mitocondrio è anche un organello dinamico che agisce come stress-detector naturale nelle cellule. Il mitocondrio coinvolge i suoi organelli partner, il nucleo e la membrana plasmatica, in modo da sviluppare una risposta cellulare ottimale alle aggressioni esterne. Ciò avviene attraverso un sofisticato sistema di comunicazione di segnali intracellulari tra mitochine (9-11). Queste proteine sono normalmente localizzate nel mitocondrio e migrano verso il nucleo e la membrana plasmatica in risposta a uno stress ambientale. Nel nucleo, le mitochine inducono l’espressione di geni anti-stress e nella membrana regolano le vie di trasmissione del segnale specifiche per lo stress in questione (Fig.1) (10,12,13).
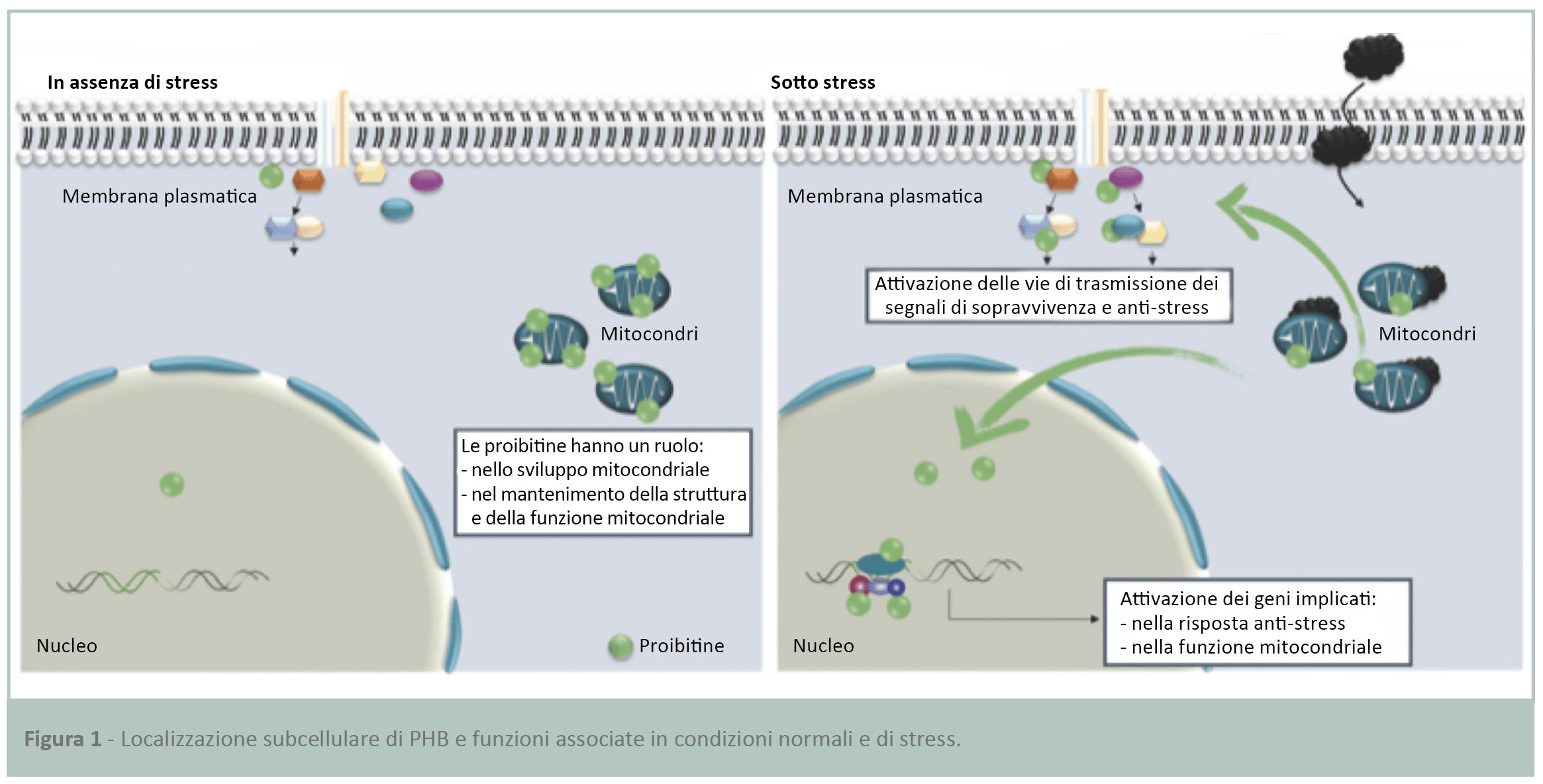
Le proibitine (PHB) sono mitochine essenziali e sono state materia della ricerca di base. Il loro ruolo chiave nelle cellule è stato dimostrato dalla loro modulazione in diversi organi in svariati contesti patologici (14-18). Le PHB sono state descritte come sentinelle cellulari per lo stress ossidativo in diversi tipi di cellule (10,19,20). Questi marker agiscono proteggendo le cellule dalle alterazioni mitocondriali. Il ruolo delle PHB è stato studiato in particolare nella broncopneumopatia cronica ostruttiva (BPCO), patologia polmonare correlata all’inquinamento. Una pubblicazione (21) ha dimostrato che l’accumulo sostanziale di stress ossidativi nelle cellule riduce l’espressione di PHB nell’epitelio polmonare. Questo deterioramento mina la stabilità dei mitocondri e indebolisce la capacità antiossidante.
A livello cutaneo, uno studio di modellizzazione preliminare ha permesso ai nostri laboratori di comprendere il ruolo del recettore arilico per gli idrocarburi AhR all’interno del meccanismo di risposta biologica di difesa attivato dall’esposizione all’inquinamento. Il lavoro ha dimostrato che la penetrazione di inquinanti (benzo[a]pirene) nei cheratinociti attiva la traslocazione del recettore Ah a livello del nucleo con la conseguente attivazione del gene target CYP1A1. La via AhR/CYP1A1 è dunque un indicatore degli effetti tossici e biochimici di queste sostanze. Questi dati supportano lo sviluppo e il lancio di un prodotto attivo naturale che inibisce il recettore Ah e il CYP1A1, migliorando conseguentemente la radiosità dell’incarnato e la grana della pelle (22).
Una seconda via biologica, complementare alla via AhR è attualmente materia di studio di un’importante ricerca: la via delle mitochine. Tuttavia, non sono disponibili ad oggi dati scientifici sulla regolazione delle mitochine in pelle esposta all’ inquinamento.
Lo studio qui descritto è stato dunque intrapreso per misurare l’impatto dell’inquinamento (particolato, benzo[a]pirene, cobalto) su questa nuova via di comunicazione intracellulare e per investigare il ruolo delle mitochine, in particolare le PHB, nella costruzione e nel mantenimento di una barriera cutanea intatta.
I risultati dimostrano che gli stress inquinanti provocano una ridotta espressione di PHB nei cheratinociti, compromettendo quindi le funzioni della barriera cutanea.
Materiali e metodi
Trasfezione dei cheratinociti umani
Cheratinociti umani normali sono stati trasfettati con 1nM PHB siRNA o con siRNA di controllo (Eurogentec, Liège, Belgio), utilizzando lipofectamine RNAimax (Invitrogen, Carlsbad CA, USA) seguendo le istruzioni del fornitore. Ventiquattro ore dopo la trasfezione, il medium è stato sostituito con il mezzo di coltura CnT-57 (CellnTec, Bern, Svizzera). In questa fase, una porzione di cellule è stata utilizzata per estrarre l’RNA e un’altra è stata seminata in inserti (NUNC, Roskilde, Danimarca) per preparare l’epidermide ricostruita.
Preparazione dell’epidermide ricostruita (SILABSKIN® RE)
Cheratinociti normali umani trasfettati con PHB siRNA e con siRNA di controllo sono stati seminati in inserti nel mezzo di coltura CnT-57 ed incubati a 37°C in atmosfera contenente 5% di CO2. Al giorno 3, i cheratinociti negli inserti sono migrati all’interfaccia aria/liquido. Il mezzo di coltura è stato cambiato ogni giorno per due settimane. Al giorno 15, le preparazioni di epidermide ricostruita sono state recuperate, fissate, disidratate e incorporate in paraffina.
Trattamento dei cheratinociti
Al giorno 0, i cheratinociti normali umani sono stati seminati in KSFM (Invitrogen) arricchito con fattori di crescita. Le cellule sono state incubate a 37°C in atmosfera contenente 5% di CO2 con o senza trattamento ripetuto con 500 nM di benzo[a]pirene (BaP) (Sigma-Aldrich, Steinheim, Germania) ai giorni 3, 4 e 5, così come con un singolo trattamento al giorno 5 con 50 μg/mL di particolato (PM) (NIST, Gaithersburg MD, USA) o con una soluzione 150 μM di cloruro di cobalto (CoCl2) (Sigma-Aldrich). Gli estratti cellulari sono stati preparati al giorno 7 e conservati a -80°C fino all’analisi.
Analisi istologica delle epidermidi ricostruite (SILABSKIN® RE)
La colorazione con ematossilina-eosina è stata condotta su sezioni di 4 μm delle epidermidi ricostruite per la misurazione dello spessore delle preparazioni epidermiche di siRNA di controllo e PHB siRNA.
Analisi immunoistochimica dei marker di differenziazione epidermica
Le sezioni da quattro μm delle epidermidi ricostruite di siRNA di controllo e di PHB siRNA sono state saturate e permeabilizzate prima dell’incubazione per 30 minuti con gli anticorpi primari anti-filaggrina (Santa Cruz Biotechnology, Dallas TX, USA), anti-citocheratina 10 (Abcam, Cambridge, UK) ed anti-loricrina (Eurogentec). Alla fine dell’incubazione e dopo risciacquo, le sezioni sono state incubate con l’anticorpo secondario Alexa Fluor® 488 (Invitrogen) per 30 minuti. La fluorescenza è stata visualizzata con microscopio IX 70 (Olympus, Tokyo, Giappone) accoppiato con un sistema di analisi delle immagini (NIS-Elements software, Nikon, Tokyo, Giappone). Il software Matlab®, versione R2012b (MathWorks, Natick MA, USA) è stato utilizzato per l’analisi quantitativa delle immagini.
Espressione della trascrizione di PHB attraverso PCR quantitativa (RT-qPCR)
Tutto l’RNA è stato estratto dai cheratinociti umani normali trasfettati con PHB siRNA o con siRNA di controllo utilizzando RNeasy kit (Qiagen, Les Ulis, Francia) seguendo le istruzioni del fornitore. I DNA complementari (cDNA) da amplificare con PCR sono stati ottenuti con ImProm-II™ Reverse Transcription System mix (Promega, Madison WI, USA) in accordo con le indicazioni del fornitore. La PCR quantitativa è stata condotta utilizzando Light Cycler 480 DNA SYBR Green PCR Master reaction mix ed analizzata con LightCycler 480 (Roche Diagnostics Limited, Burgess Hill, UK). La normale espressione relativa di PHB è stata ristabilita con il gene HPRT1.
Espressione proteica di PHB mediante Western blot
Gli estratti proteici sono stati ottenuti mediante lisi dei cheratinociti trattati o meno con benzo[a]pirene, particolato o cloruro di cobalto. Dopo il saggio, le proteine sono state depositate in gel TGX (Bio-Rad, Hercules CA, USA) per l’elettroforesi. Dopo il trasferimento su membrana e la saturazione dei siti non specifici, le membrane sono state incubate per la notte con gli anticorpi primari anti-PHB (Abcam) e anti-actina (Santa Cruz Biotechnology), dopodiché le membrane sono state sciacquate e incubate per 1 ora con l’anticorpo secondario HRP (Dako, Glostrup, Danimarca). Le proteine sono state visualizzate con chemiluminescenza e semi-quantificate con densitometro con camera LAS-4000 CCD (Fujifilm, Tokyo, Giappone) e analizzate con software Multigauge (Fujifilm).
Analisi statistica
I risultati della quantificazione sono stati presentati come medie di valori ±SEM. Il test t di Student è stato usato per determinare la significatività dei risultati ottenuti: *p<0,05; **p<0,01; ****p<0,001.
Risultati
Effetto dell’inquinamento sulla via delle mitochine
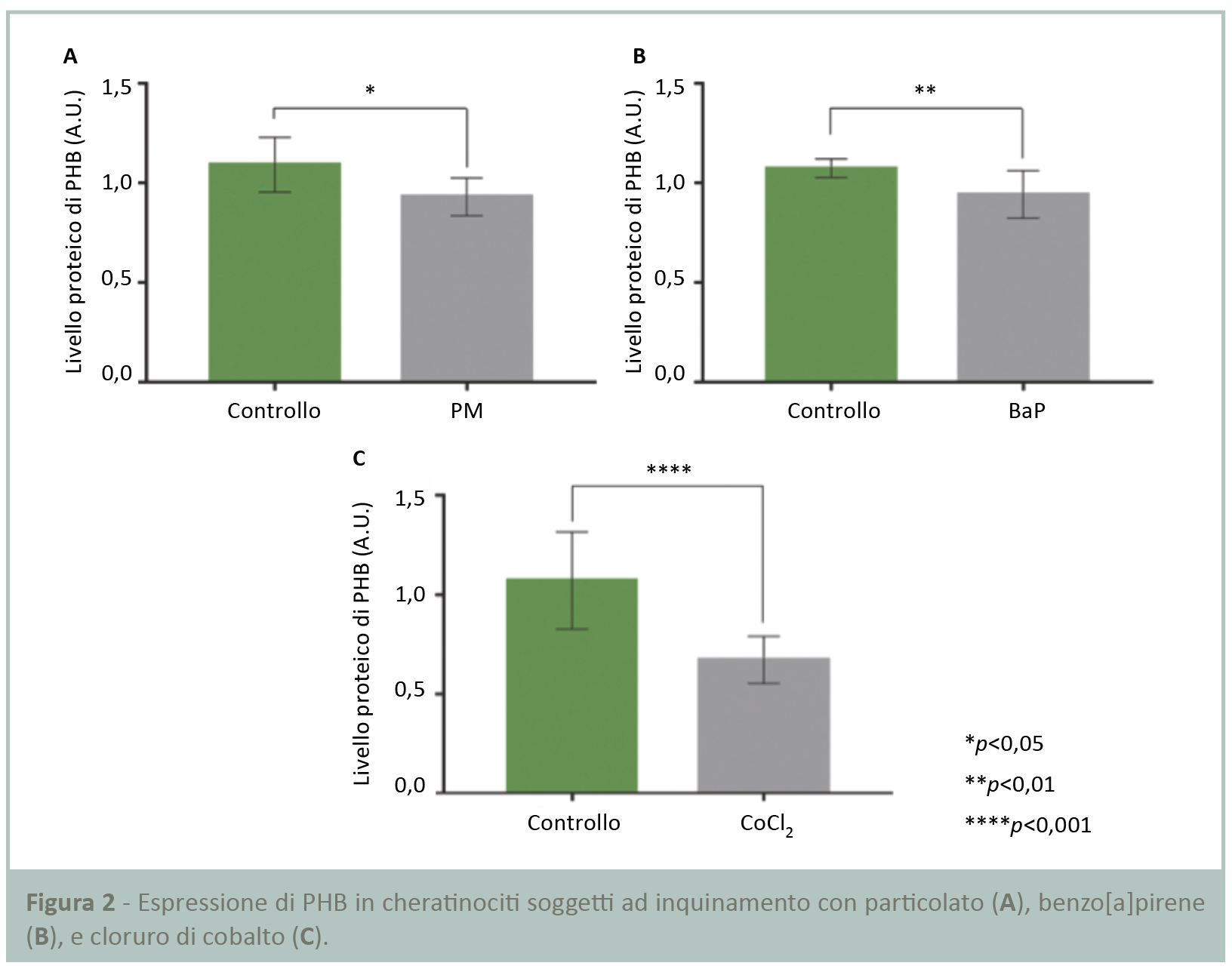
Le PHB sono proteine essenziali alla cellula per l’attivazione della risposta anti-stress. Essendo la pelle esposta ogni giorno all’inquinamento interno e/o esterno, è stato deciso di valutare l’impatto di quest’ultimo sulle PHB. Ciò è stato fatto determinando l’influenza di cause e conseguenze dell’inquinamento sull’espressione delle PHB.
L’inquinamento è stato riprodotto sottoponendo normali cheratinociti umani a due diversi stress: l’esposizione al particolato (PM) e al benzo[a]pirene (BaP). L’analisi Western blot ha dimostrato che in questo contesto l’espressione delle PHB è significativamente ridotta rispettivamente del 15 e 12% (Figg.2A,B) senza effetto sulla vitalità cellulare (dati non presentati).
L’inquinamento atmosferico causa carenza di ossigeno, ragion per cui SILAB ha analizzato l’effetto di questa conseguenza dell’inquinamento sull’espressione delle PHB nell’epidermide.
I cheratinociti sono stati sottoposti a stress ipossico mediante cloruro di cobalto per 24 ore. I risultati dell’analisi Western blot (Fig.2C) hanno dimostrato una riduzione significativa del 37% dell’espressione delle PHB nei cheratinociti in condizioni di carenza di ossigeno.
Validazione dell’inibizione dell’espressione di PHB nei cheratinociti
L’azione protettiva di PHB in diversi tipi di cellule è stata descritta in letteratura, motivo per cui SILAB ha deciso di investigare se quest’azione benefica potesse essere trasposta alle cellule cutanee umane.
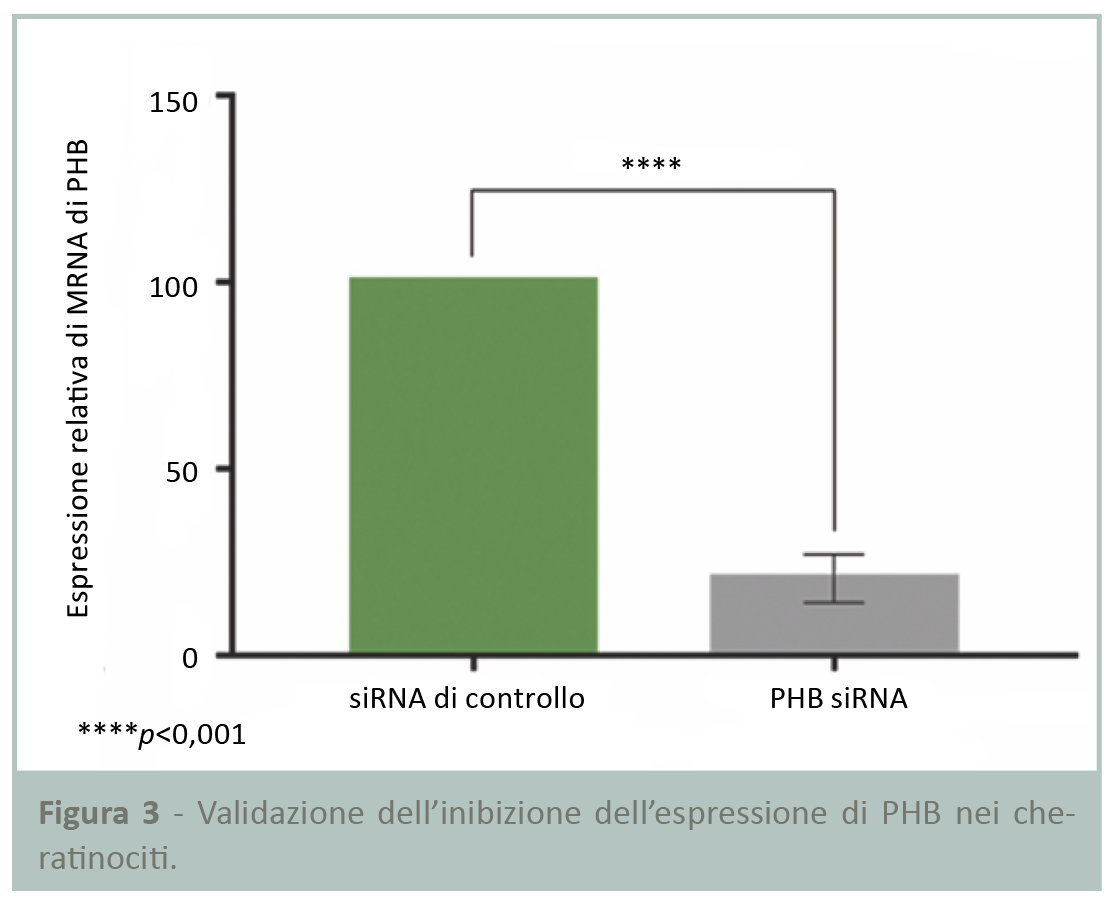
L’espressione di PHB nei cheratinociti è stata inibita utilizzando la tecnica dell’RNA interferente breve (siRNA) per determinare l’impatto dell’assenza di questa proteina sulla costruzione epidermica. La prima fase ha richiesto la validazione dell’inibizione dell’espressione di PHB nei cheratinociti antecedentemente alla costruzione dell’epidermide.
I risultati della RT-qPCR in Figura 3 mostrano una significativa riduzione dell’80% dell’espressione di PHB dopo la trasfezione delle cellule con siRNA, validando pertanto il modello e permettendo il proseguimento dello studio.
Studio morfologico dell’epidermide ricostruita
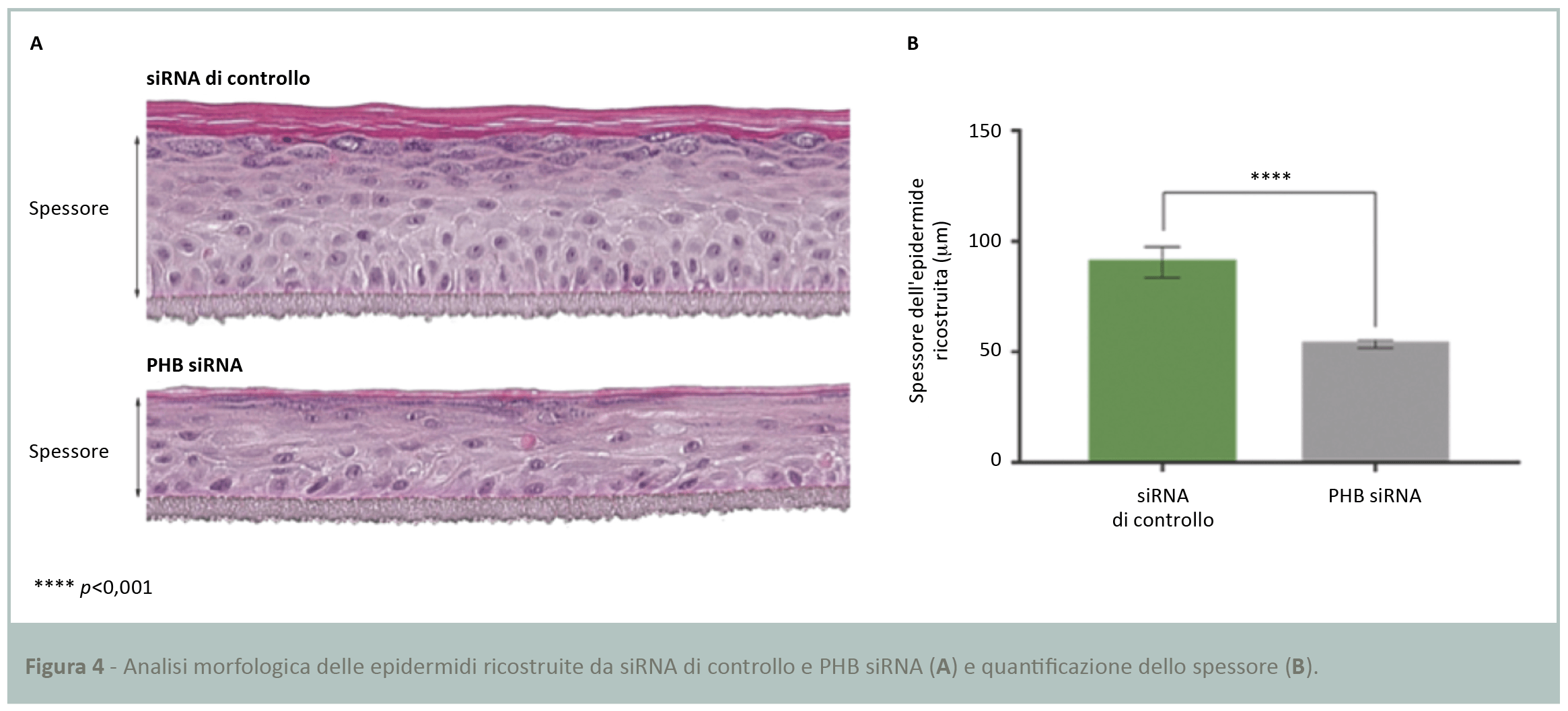
La fase successiva ha richiesto l’analisi morfologica delle due preparazioni di epidermide ricostruita trasfettate con siRNA di controllo e PHB siRNA, per valutare la qualità della costruzione epidermica in base allo spessore. Dopo fissazione e colorazione con ematossilina-eosina è stata evidenziata una netta differenza della morfologia degli strati di cheratinociti, più sottili in assenza di PHB (Fig.4A). La successiva quantificazione dello spessore ha confermato una significativa differenza del 40% tra le due preparazioni epidermiche (Fig.4B).
Il modello 3D di epidermide ricostruita ottenuto dal siRNA di controllo è pluristratificato e consiste in uno strato basale, diverse file di cellule a costituire lo strato spinoso, strato granuloso e di uno strato corneo. Questi risultati suggeriscono un ruolo fondamentale di PHB per la costruzione di un’epidermide intatta.
Analisi dell’espressione dei marker della differenziazione epidermica
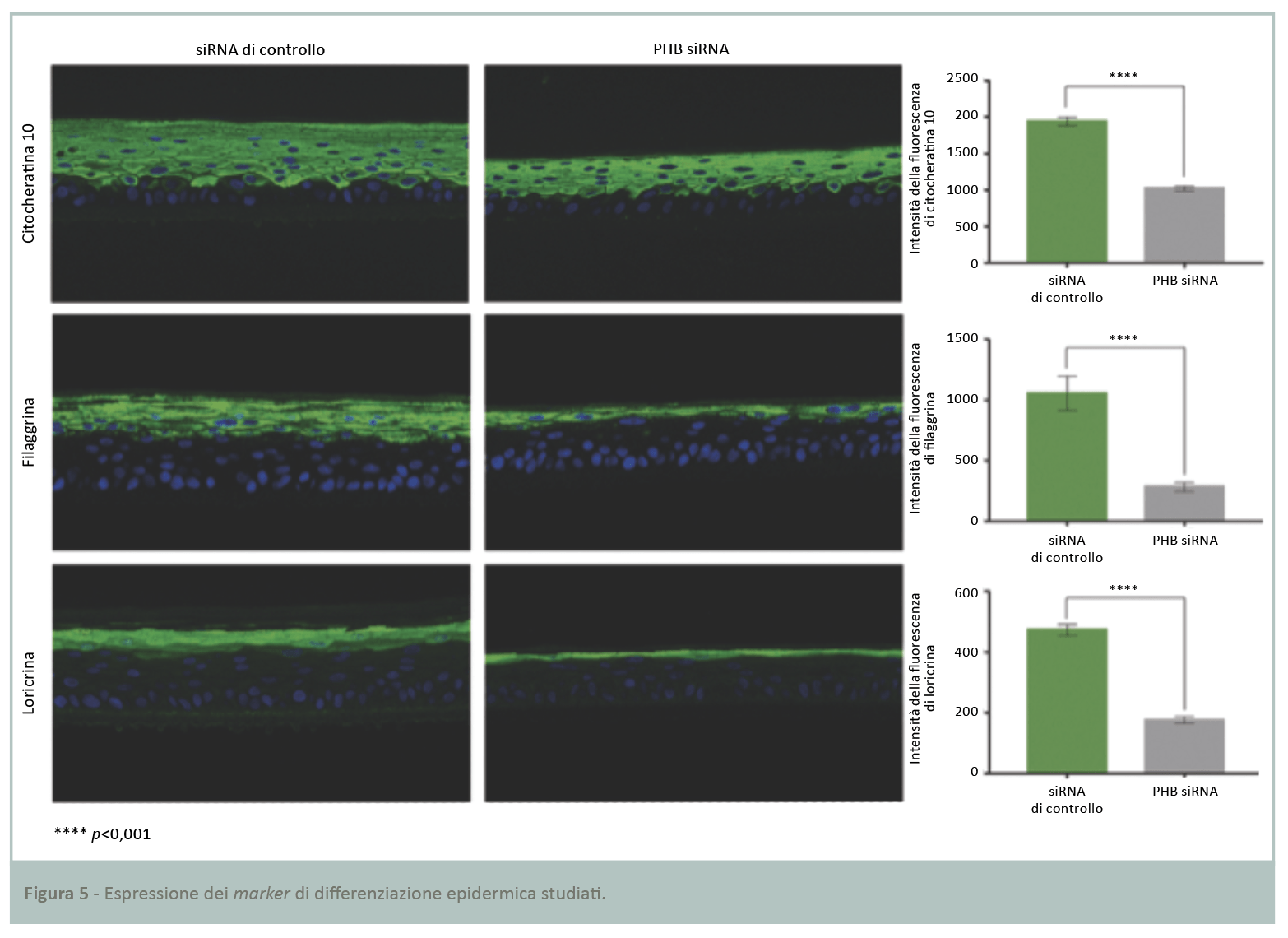
Lo studio precedente ha dimostrato una riduzione dello spessore dell’epidermide ricostruita a seguito dell’inibizione di PHB. È stato dunque deciso di analizzare il metabolismo dei cheratinociti, studiandone il processo di differenziazione. I marker scelti rappresentano quelli maggiori di differenziazione, specifici degli strati soprabasali dell’epidermide che riflettono la corretta differenziazione epidermica. I tre marker presi in considerazione sono: citocheratina 10, una proteina strutturale dei filamenti intermedi; filaggrina, alla base degli aggregati dei filamenti intermedi; loricrina, una proteina strutturale dell’involucro interno corneificato. La quantificazione attraverso analisi immunoistochimica a fluorescenza (Fig.5) ha rilevato una significativa riduzione dell’espressione dei tre marker di differenziazione nell’epidermide ricostruita carente di PHB rispetto a quella di controllo. I livelli di citocheratina 10, filaggrina e loricrina sono ridotti rispettivamente del 47, 73 e 63%.
I risultati dimostrano il ruolo chiave di PHB nel processo di differenziazione epidermica e nella costruzione di una funzione barriera intatta.
Conclusioni
Lo studio di modellizzazione qui descritto è stato intrapreso al fine di stimare l’impatto dell’inquinamento sull’espressione di mitochine nei cheratinociti, in particolare PHB, e per investigare il loro ruolo nella costruzione di un’epidermide funzionale ricostruita. I risultati mostrano chiaramente una stretta correlazione tra l’espressione di queste mitochine a livello cutaneo e la presenza di inquinamento.
Nell’affrontare uno stress ossidativo come l’inquinamento, le PHB sono coinvolte nel mantenimento dell’integrità della “respirazione” mitocondriale (catena di trasporto degli elettroni). La rete di comunicazione di queste proteine è tale da riuscire a minimizzare la produzione di radicali liberi attivando le vie di trasduzione del segnale e i geni necessari a sostenere uno stress moderato. Ciò porta alla creazione di un circolo vizioso che funzioni nonostante l’espressione di PHB, sensibile a un prolungato stress ossidativo, venga alterata e le proteine non possano più assicurare la loro funzione protettiva (10,23).
Nella prima fase della modellizzazione, SILAB ha dimostrato che l’inquinamento affrontato quotidianamente porta a una riduzione dell’espressione di PHB nei cheratinociti. Questo suggerisce che persino un’esposizione ridotta all’inquinamento (3 giorni per il benzo[a]pirene, un giorno per il particolato e il cobalto) possa essere sufficiente per alterare il sistema protettivo delle PHB. Disturbi della rete di comunicazione tra il mitocondrio, il nucleo e la membrana plasmatica portano all’invecchiamento prematuro e alla comparsa di disturbi legati all’invecchiamento (10). Inoltre, diversi studi hanno dimostrato che la perdita di PHB ha effetti dannosi su diversi organi, tra cui i reni (14), il cuore (18), il sistema nervoso (17), il fegato (16) e i polmoni (21).
Ad oggi, non ci sono apparentemente dati disponibili sulle conseguenze di questa perdita di PHB a livello cutaneo. Il modello qui descritto ha rivelato che una perdita di attività di queste mitochine nei normali cheratinociti umani deteriora la costruzione dell’epidermide e il suo ruolo di funzione barriera. A seguito della riduzione dell’espressione di PHB, si è verificata una diminuzione significativa dello spessore epidermico e dell’espressione delle principali proteine della differenziazione epidermica. Questo lavoro di modellizzazione ha dimostrato per la prima volta il ruolo essenziale di questi marker nella costruzione di una funzione barriera intatta. I risultati indicano che i disturbi dell’omeostasi cutanea osservata in un contesto di inquinamento (distruzione della funzione barriera, incarnato spento e invecchiamento precoce) potrebbero essere dovuti almeno in parte alla perdita di PHB nei cheratinociti.
Ristabilire livelli normali di PHB nelle cellule è stato descritto in letteratura come un rilevante approccio terapeutico per combattere lo stress ossidativo e i conseguenti danni mitocondriali in diversi tipi di cellule (10,11,20,23). I dati pubblicati in questo lavoro e gli studi di SILAB dimostrano la sostanziale importanza di preservare il “capitale” di queste mitochine nella pelle nelle strategie pensate per contrastare gli effetti dannosi dell’inquinamento.
Il lavoro di modellizzazione qui descritto ha costituito la base per lo sviluppo di un ingrediente attivo cosmetico innovativo e naturale derivante da biotecnologie, che presenta una duplice efficacia. I glucomannani estratti dal lievito di Pichia heedii riportano la sintesi di PHB a livelli normali in contesti di inquinamento e sono in grado di inibire AhR e il suo gene target CYP1A1. Questo prodotto ad alto potere antinquinante protegge la pelle fragile dalle aggressioni urbane e migliora il colorito e la radiosità dell’incarnato delle pelli caucasiche e asiatiche (dati non presentati).
Bibliografia
1. Krutmann J, Liu W. Li L et al (2014) Pollution and skin: From epidemiological and mechanistic studies to clinical implications. J. Dermatol Sci 76:163-168
2. Mancebo SE, Wang SQ (2015) Recognizing the impact of ambient air pollution on skin health. J Eur Acad Dermatol Venereol 29:2326-2332
3. Kim KE, Cho D, Park HJ (2016) Air pollution and skin diseases: Adverse effects of airborne particulate matter on various skin diseases. Life Sci 152:126-134
4. Pan TL, Wang PW, Aljuffali IA et al (2015) The impact of urban particulate pollution on skin barrier function and the subsequent drug absorption. J Dermatol Sci 78:51-60
5. Vierkötter A, Schikowski T, Ranft U et al (2010) Airborne Particle Exposure and Extrinsic Skin Aging.J Invest Dermatol 130:2719-2726
6. Valacchi G, Sticozzi C, Pecorelli A et al (2012) Cutaneous responses to environmental stressors. Ann N Y Acad Sci 1271:75-81
7. Iwai I, Ikuta K, Murayama K, Hirao T (2008) Change in optical properties of stratum corneum induced by protein carbonylation in vitro. Int J Cosmet Sci 30:41-46
8. Magnani ND, Muresan XM, Belmonte G et al (2016) Skin Damage Mechanisms Related to Airborne Particulate Matter Exposure. Toxicol Sci Off J Soc Toxicol 149:227-236
9. Quirós PM, Mottis A, Auwerx J (2016) Mitonuclear communication in homeostasis and stress. Nat Rev Mol Cell Biol 17:213-226
10. Sripathi SR, He W, Atkinson CL et al (2011) Mitochondrial-nuclear communication by prohibitin shuttling under oxidative stress. Biochemistry (Mosc.) 50:8342-8351
11. Mishra S, Murphy LC, Nyomba BL, Murphy LJ (2005) Prohibitin: a potential target for new therapeutics. Trends Mol Med 11:192-197
12. Van Aken O, Whelan J, Van Breusegem F (2010) Prohibitins: mitochondrial partners in development and stress response. Trends Plant Sci 15:275-282
13. Thuaud F, Ribeiro N, Nebigil CG, Desaubry L (2013) Prohibitin ligands in cell death and survival: mode of action and therapeutic potential. Chem Biol 20:316-331
14. Ising C, Bharill P, Brinkkoetter S et al (2016) Prohibitin-2 Depletion Unravels Extra-Mitochondrial Functions at the Kidney Filtration Barrier. Am J Pathol 186:1128-1139
15. Ande SR, Nguyen KH, Gregoire Nyomba BL, Mishra S (2016) Prohibitin-induced, obesity-associated insulin resistance and accompanying low-grade inflammation causes NASH and HCC. Sci Rep 6:23608
16. Ko KS, Tomasi ML, Iglesias-Ara A et al (2010) Liver-specific deletion of prohibitin 1 results in spontaneous liver injury, fibrosis, and hepatocellular carcinoma in mice. Hepatol Baltim Md 52:2096-2108
17. Merkwirth C, Martinelli P, Korwitz A et al (2012) Loss of prohibitin membrane scaffolds impairs mitochondrial architecture and leads to tau hyperphosphorylation and neurodegeneration. PLoS Genet 8:e1003021
18. Dong WQ, Chao M, Lu QH et al (2016) Prohibitin overexpression improves myocardial function in diabetic cardiomyopathy. Oncotarget 7:66
19. Li Y, Wang HY, Liu J et al (2016) Characterization of Prohibitins in Male Reproductive System and their Expression under Oxidative Stress. J Urol 195:1160-1167
20. Zhou P, Qian L, D’Aurelio M et al (2012) Prohibitin reduces mitochondrial free radical production and protects brain cells from different injury modalities. J Neurosci Off J Soc Neurosci 32:583-592
21. Soulitzis N, Neofytou E, Psarrou M et al (2012) Downregulation of lung mitochondrial prohibitin in COPD. Respir Med 106:954-961
22. Guzman-Struillou A, Boudier D, Lalande F, Pinel M, Closs B (2015) Targeting the Ah receptor: a new antipollution strategy. Personal Care 8:77-79
23. Chowdhury D, Kumar D, Bhadra U et al (2016) Prohibitin confers cytoprotection against ISO-induced hypertrophy in H9c2 cells via attenuation of oxidative stress and modulation of Akt/Gsk-3β signaling. Mol Cell Biochem doi:10.1007/s11010-016-2870-3
SILAB è distribuita esclusivamente in Italia da Active Up – Milano
tel 02 58019182 • support@activeup.it • www.activeup.it
Articolo pubblicato su “IFSCC Magazine, Marzo 2017”.

